|
小話
雑記です。「そーなんだ、ふーん」程度の参考としてください。
もしこれらを盲信し、何らかの障害が発生したとしても、責任をおいかねますのでご注意ください。
上にあるものほど、あたらしい小話ですが、世間一般に新しい話というわけではありません。
書いた順です。すみません。
あと、準備中にカテゴライズしておきながら、それらについてはなかなか記事にしていません。
思いつくままに記事を追加しているので、そこら辺のいい加減な部分も寛大な心でご容赦ください。
shigemi tubeの最後のひとおし
1st draft 2023.5.25
last update 2023.5.25
 shigemi社製の対称型微量サンプルチューブ(通称、shigemi管)は、普段から溶液タンパク質NMRを測定する上で非常にお世話になっている。NMR測定に使用するサンプル液量を、通常600 uL程度が必要なところ、250 uLでの測定が可能であり、これは高濃度のサンプルを用意するうえで非常に重要である。
shigemi社製の対称型微量サンプルチューブ(通称、shigemi管)は、普段から溶液タンパク質NMRを測定する上で非常にお世話になっている。NMR測定に使用するサンプル液量を、通常600 uL程度が必要なところ、250 uLでの測定が可能であり、これは高濃度のサンプルを用意するうえで非常に重要である。
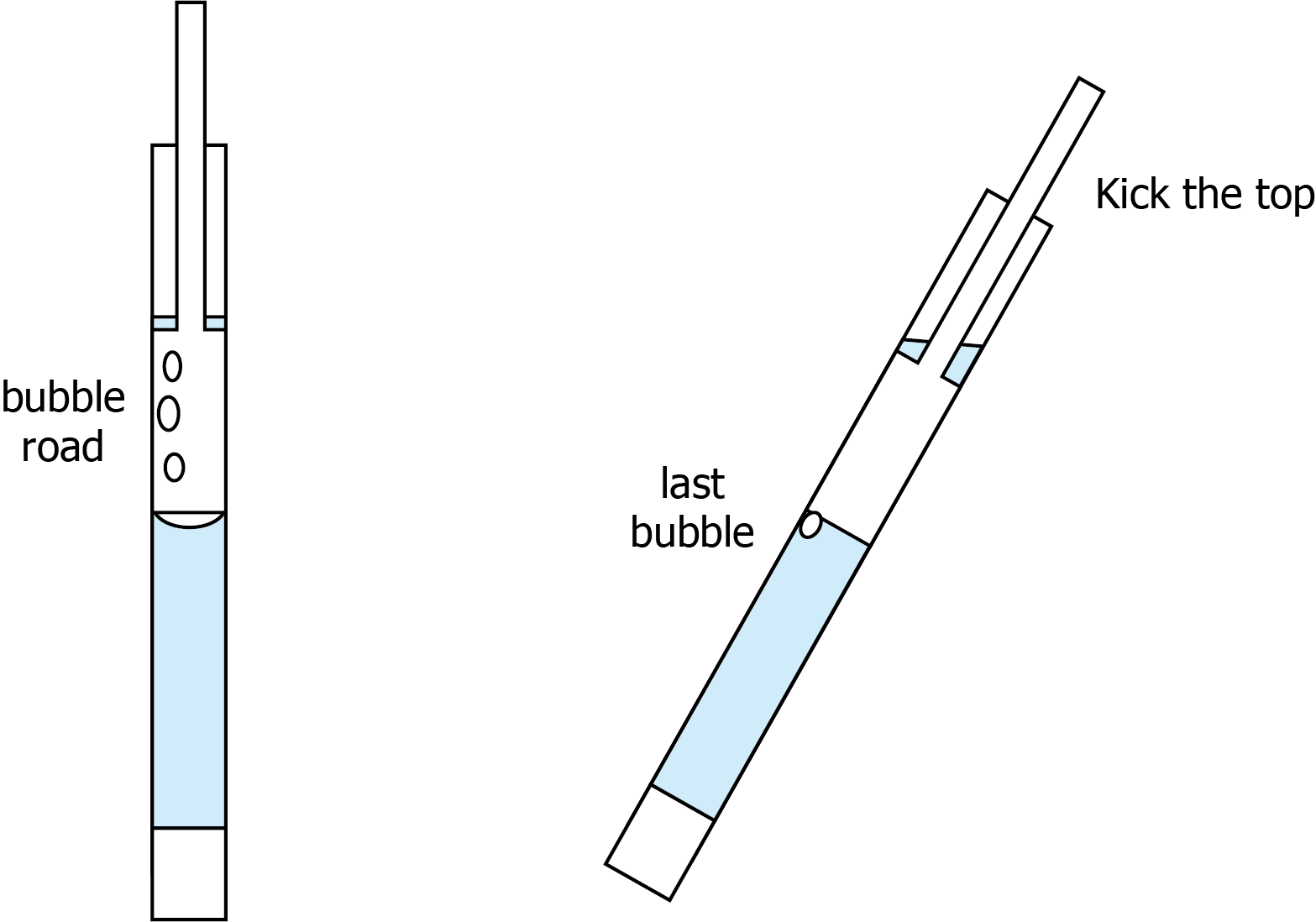
shigemi管を準備するとき、サンプルの溶液部分(上底と内管の間の部分)から気泡を除去(以下、泡抜き)せねばならず、また特にタンパク質溶液は泡が発生しやすいため、これは初心者泣かせな操作である(泡抜き方法の動画が公開されているが、これは熟練者のものだろう)。筆者はこれまでに数百本ぐらいは、泡抜きをしている(それ以上かも。数えてません)。そのなかで、役に立ちそうな小技を紹介する。
内管をサンプル溶液につけて少し押し込んだときに、液体とともに泡が上方に向かって移動する。このときに、泡が通った場所を記憶しておく。ここが泡が通りやすい場所である。この泡が通りやすい場所を上になるようにshigemi管を傾け、最後の気泡と通り道を近づける。この状態で、内管のトップを指で叩くと泡抜きが達成しやすい。
経験則に基づいているため最適解ではないかもしれないが、かなりきつめのケースであっても泡抜きできているので個人的にオススメする。あとどこかのコミュニケーションサイトにおいても同じ情報を載せている。またそのサイトでは、こんな小技だけではなく、非常に有用な情報が盛り沢山となっているため、そちらもぜひ参考されたい。
新しい重溶媒条件を追加してのtopshim 3d
1st draft 2023.5.25
last update 2023.5.25
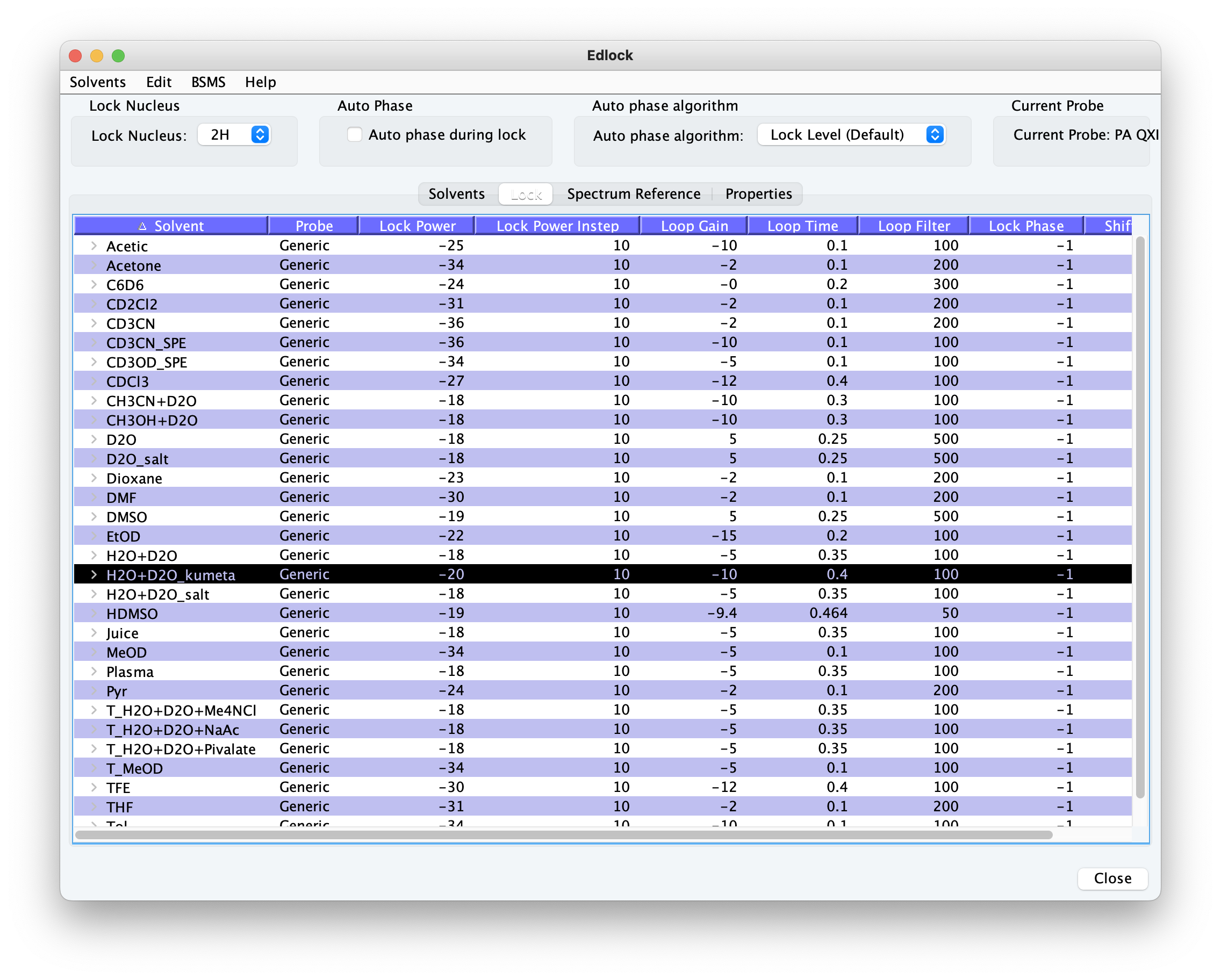 周波数ロックを行うときには、lockコマンドによりロックに使用する溶媒を選択する。新しい溶媒系(90% H2O+10% d6-DMSOなど)を用いたいときや、iconNMRにおける自動測定のときにシム上げ方法を条件分けしたいときなど、それをあらかじめロック溶媒リストに追加しておく必要がある。ロック溶媒リストの編集は、edlock(呼び出しコマンドもedlock、要管理者パスワード)によって行う。ロック溶媒情報の編集、たとえば2種類の重水素信号が含まれている場合に、両者の化学シフト値の設定ならびに、どちらをロック信号とするかなどの設定が可能である。
周波数ロックを行うときには、lockコマンドによりロックに使用する溶媒を選択する。新しい溶媒系(90% H2O+10% d6-DMSOなど)を用いたいときや、iconNMRにおける自動測定のときにシム上げ方法を条件分けしたいときなど、それをあらかじめロック溶媒リストに追加しておく必要がある。ロック溶媒リストの編集は、edlock(呼び出しコマンドもedlock、要管理者パスワード)によって行う。ロック溶媒情報の編集、たとえば2種類の重水素信号が含まれている場合に、両者の化学シフト値の設定ならびに、どちらをロック信号とするかなどの設定が可能である。
H2O+D2Oなど、軽水が多く含まれている溶媒のときにはプロトン信号を利用したtopshim 3dが可能である(重溶媒のみの場合には3dは使えない。fullもfailとなる)。しかし、上記の方法で作成した新しい溶媒条件ではtopshim 3dが使用できない。
edlockによって編集されるファイルは、solvents.xmlであるが、topshimが参照する別ファイルとしてtopshim/solventsフォルダがあり、その下に溶媒ごとのtopshimのための条件ファイルが入っている。ファイルの場所は、それぞれ以下の通り
| solvents.xml | topspin_home/conf/inst/ |
| topshim/solvents/ | topspin_home/conf/inst/topshim/solvents |
後者は、topshim solvconfによる対話形式の設定、もしくは手動設定が必要である。手動設定するときには、雛形となりそうなファイルをtopshim/solvents/user/の下にコピーして編集するのが良いだろう。
2次溶媒信号を消去した二次元測定
1st draft 2021.10.12
last update 2021.10.12
 依頼測定において預かったサンプルのなかに、水とそれ以外の溶媒由来信号が含まれてる場合がある。
例えば、水とヘリックス誘導剤であるTFEの混合溶媒などである。
D化TFEを使用すればもちろん観測できなくなるが、D化溶媒が売っていない、売っていてもとても高額など、これらは実験をすすめる上で障壁になりうる。
また、共同研究先に高額なD溶媒をポーンと買ってもらうことにも、気が引けることがたまーにある。
(自前で買うことは考えられないし考えない)。
依頼測定において預かったサンプルのなかに、水とそれ以外の溶媒由来信号が含まれてる場合がある。
例えば、水とヘリックス誘導剤であるTFEの混合溶媒などである。
D化TFEを使用すればもちろん観測できなくなるが、D化溶媒が売っていない、売っていてもとても高額など、これらは実験をすすめる上で障壁になりうる。
また、共同研究先に高額なD溶媒をポーンと買ってもらうことにも、気が引けることがたまーにある。
(自前で買うことは考えられないし考えない)。
2次溶媒信号が含まれている場合、TopSpinにおいてはLCシリーズが使用できる。(rparにて、検索語句をLC*にすると出てくる)
詳しくは、Bruker NMRチュートリアル、溶液初級または中級にて取り扱われているはずなので、興味のある方々はこれを受講すると良いだろう。
ここでは、このLCシリーズの思想を利用して、f2-presatを使ったTOCSYやNOESYについて紹介する。
presaturationは、ZGPRなどで水信号消去の基本測定として使用している手法である。
観測中心に水を設定し、出力の低いパルスを長時間(1〜2秒)当て続けることで観測中心付近の信号に対してのみ飽和を起こし観測できないようにしている。
これを利用し、異なる周波数をもつ信号に対して飽和パルスを照射し信号を消失させる。
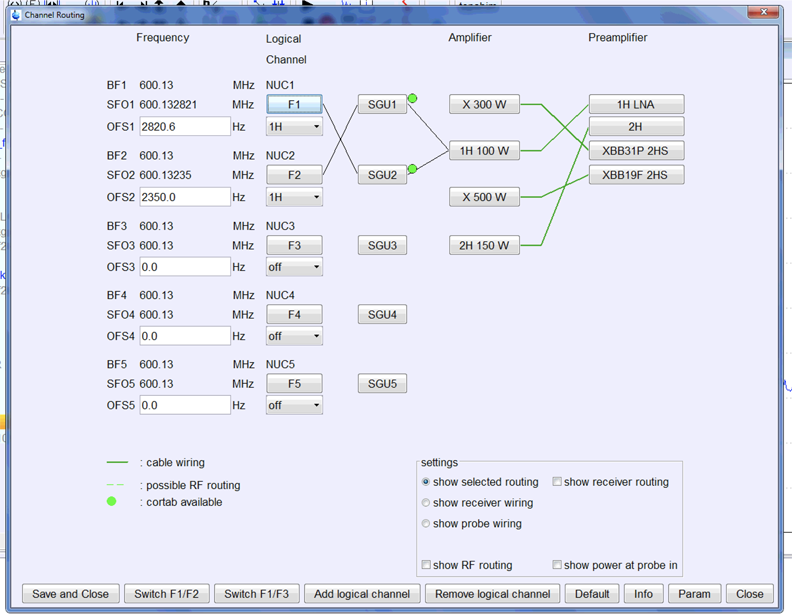
edaspにてf2-channelなど使用していないlogical channelを核種を1Hとして結線し、飽和させたい周波数をOFSに設定する。
違和感のある配線になるが右上の図のような配線になる。
今回作成するTOCSYやNOESYには、水信号も多く含まれるサンプルであるため水消しも必要である。そのためes法(excitation sculpting)のものをベースに作成した。
今回は一つの溶媒信号のみを消去する手法で紹介したが、logical channelが余っていれば複数の溶媒信号も消去可能であろう。ただ、あまりにも消去したい溶媒信号が多い場合には、selectiveパルスを用いて見たい信号のみ観測する手法の方が効率的と思う。
2次溶媒信号消去のためのパルス出力の強さは、どの程度の溶媒信号があるかに依存する。今回のサンプルは、10% TFEであり、かなり多めに存在していたため24dBとした(ZGPRでの水消し時は、43.6dBの装置)。これはそれぞれのサンプルにおいて1次元測定を行い最適値を見つけることをお勧めする。
ハードウェアトラブル事例
1st draft 2021.6.26
last update 2021.6.27
 当施設では複数のNMR装置について維持管理している。長年の維持管理においてハードウェアトラブルは、よく体験する。それらのトラブルの症状と解決方法のなかで、のちのち参考となりそうなものを抜粋して備忘録として記載する。
当施設では複数のNMR装置について維持管理している。長年の維持管理においてハードウェアトラブルは、よく体験する。それらのトラブルの症状と解決方法のなかで、のちのち参考となりそうなものを抜粋して備忘録として記載する。
周波数シンセサイザー(Agilent)
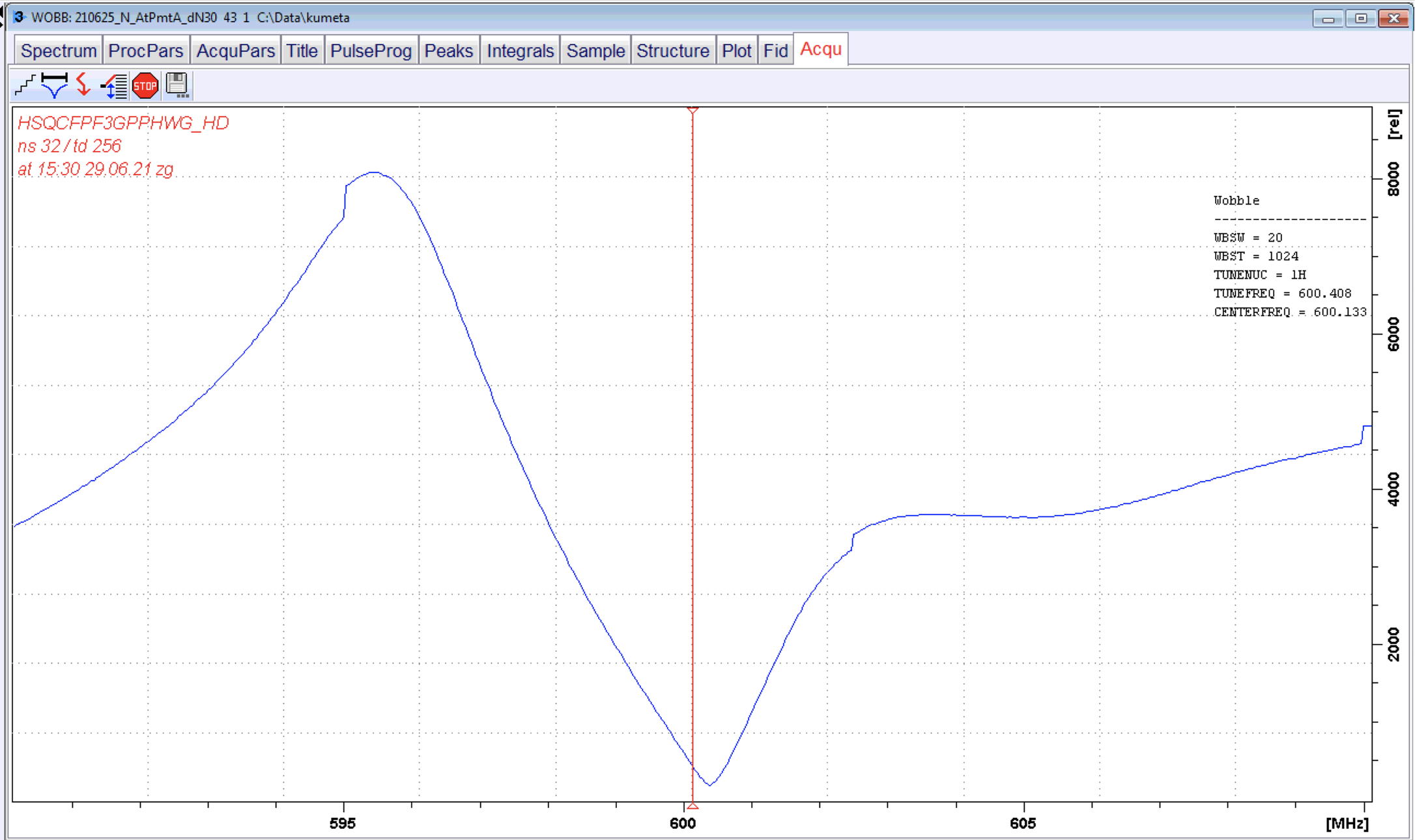
症状:チューニングdipの画面上(Brukerならばwobbの画面)で見慣れない形状が計測された(写真がなくて申し訳ないが、バランのような形状)。プロトン1次元測定などでノイズが大量に発生した。
対処:初めにレシーバーを疑い交換したが改善しなかった。つぎにPTS(シンセサイザー)を交換し症状が改善できたため、故障箇所がPTSと特定した。
メーカーエンジニア(Agilent)に問い合わせたところ、PTSユニットの丸ごと交換は高額である旨と内部コンデンサ交換で解決できれば安価で済むとの助言を受けた(100万オーバーから1万円程度に)。
学内の有識者によりコンデンサを購入いただき、交換。無事に解決できた。交換に使用したコンデンサ以外には、各種ドライバー、ラジオペンチ、はんだごて、はんだ、はんだ剥がしシールを使用した。動画でもとればよかった。
周波数フィルタ(Bruker)
症状:13C HSQC / HMQC測定中にADC overflowが不定期に発生。rgaしていても発生。
対処:13C decouple付きの1Hの一次元パルスを作成し検証。スペクトル上に多数の周期的なノイズが発生していた。
13Cのライン外しやdecoupleパルスパワーを0Wにすると発生しないことを確認。13Cのラインからくるノイズと判断。
フィルタを在庫から探してテスト。手持ちのBruker製フィルタではノイズを除去できなかったが、Agilent製のフィルタで除去できた。とっておいてよかった(根っからの貧乏性)。
shaped pulseの話
1st draft 2021.6.8
last update 2021.6.9
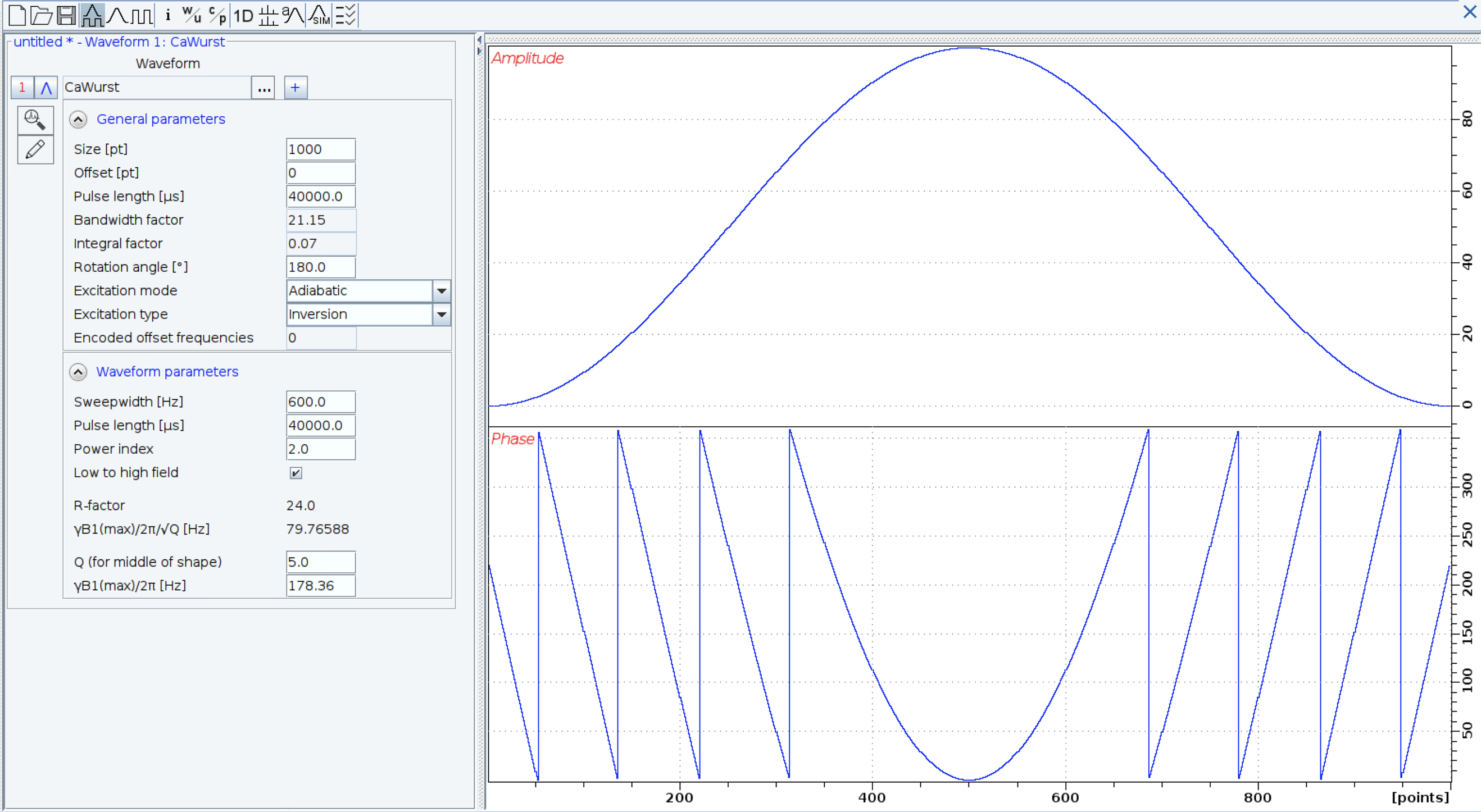 ハードパルスを必要としない場合や出力の強いパルスを照射したくないときなどに使用するshaped pulseは、昨今のパルスシークエンスにはほぼ必ずと言っていいほど登場する。化学シフト値特異的なパルス、いわゆる選択的パルスはselective実験やSTD実験で使用されているし、Adiabatic pulseは低分子HSQCでの解析を助けてくれる。タンパク質NMRにおいても、watergate実験における水消しに始まり、広い観測幅をもつAliphatic Carbonのデカップルパルス、HCNの三次元測定の13Cパルス、CS/TCSのための飽和パルス測定、sofast測定やselective HMQC-NOESY-HMQC測定など、ありとあらゆる場面で登場してくる。
ハードパルスを必要としない場合や出力の強いパルスを照射したくないときなどに使用するshaped pulseは、昨今のパルスシークエンスにはほぼ必ずと言っていいほど登場する。化学シフト値特異的なパルス、いわゆる選択的パルスはselective実験やSTD実験で使用されているし、Adiabatic pulseは低分子HSQCでの解析を助けてくれる。タンパク質NMRにおいても、watergate実験における水消しに始まり、広い観測幅をもつAliphatic Carbonのデカップルパルス、HCNの三次元測定の13Cパルス、CS/TCSのための飽和パルス測定、sofast測定やselective HMQC-NOESY-HMQC測定など、ありとあらゆる場面で登場してくる。
Brukerの装置における基本のshaped pulseセットはedprosolによって閲覧することができる。1Hや13Cなどのハードパルスの長さ(usec)と強さ(W、またはdB)を入力し、「電卓ボタン」を押せば適切なパルスの強度を自動で計算してくれる。ただ設定を保存するときにパスワードを要求されることからもわかるとおり、これらの設定変更は熟達した人のみが可能とすることが運用上、必須だろう。
測定者がサンプルに適したshaped pulse強度にしたいときにはgetprosolコマンドを使用すると良いだろう。getprosol 1H 11.4 12Wの要領で1Hに対してのハードパルス設定値、この場合には、11.4 usec、12Wの90˚ハードパルスパラメータを入力することで、それぞれのshaped pulseについて最適なパワー値を計算しパラメータとして入力してくれる。さらに面倒くさがりな場合は、pulsecalで良いだろう。
このgetprosolおよびpulsecalでは、shaped pulseについて対応するパルス名と長さが自動で読み込まれる。例えば、hncogpwg3dであれば「SPNAM2」に、「Cali/CO 90˚」に入力されているshaped pulseが読み込まれる(たぶん、どの装置、どのTopSpinバージョンであってもQ5.1000が入るはず)。これらはAcquParsの記載に従うのでははく、pulprogの頭の方に記載されている、「prosol relations=<triple>」に従って自動選択されて入力される。
パルスの変数名と自動選択されるパルスの対応表は、「prosol」フォルダの下にある「triple」ファイルの中に記載されている。この「triple」ファイルは、
| topspin_home/conf/inst/spect/prosol/pulseassign |
| topspin_home/exp/stan/nmr/lists/prosol/pulseassign |
の、どちらかにある。このファイルの編集もパルスプログラミングをできるぐらいの人のみが可能としておくことが必須だろう。というか、パルスプログラミングをする人以外に、このファイルを編集する必要性は無いと思うが。
shaped pulseを自分でデザインするときには、shape tool (stdisp)を使用する。TopSpin v 4.1?からは、大きく仕様が変更された。shape toolによる編集インターフェースにも大きな変更があったが、筆者にとって最も都合が良かった部分はshaped pulseの雛形にwurstが入ったことである。wurstの作者がTopSpinの開発に深く関わってきているのかもしれない。同様にshapedファイルの記述方法も大きく様変わりした。興味があれば比較と参考をすると良いかもしれない。
| Topspin 4.1?以降のstdispの雛形フォルダ | topspin_home/exp/stan/nmr/wavemaker/shapes |
| Topspin 3.2なども共通のshapedファイル保存場所 | topspin_home/exp/stan/nmr/lists/wave |
define RF fieldの話
1st draft 2021.5.6
last update 2021.5.6
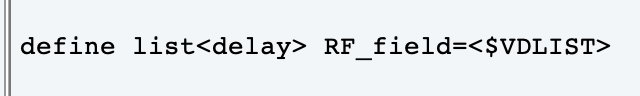 15N標識を用いた溶液タンパク質NMR測定におけるT1/T2およびNOE測定、R2-dispersion法などにおいて、本来、複数枚の2次元測定が必要になるところを擬似的に3次元測定とする測定方法は、わりと一般的に用いられている。Pseudo 3D法とも呼ばれる、この測定方法は任意に変更させたいパラメータについて3次元目としている。例えば、T1やT2であればパルスの待ち時間であるdelayをユーザー任意(variable)な値として、3次元目にこの値を割り振る設定をしている(この軸はFnMODEがQFになる)。割り振る値は、VDLISTで指定したテキストファイルを用いる。
15N標識を用いた溶液タンパク質NMR測定におけるT1/T2およびNOE測定、R2-dispersion法などにおいて、本来、複数枚の2次元測定が必要になるところを擬似的に3次元測定とする測定方法は、わりと一般的に用いられている。Pseudo 3D法とも呼ばれる、この測定方法は任意に変更させたいパラメータについて3次元目としている。例えば、T1やT2であればパルスの待ち時間であるdelayをユーザー任意(variable)な値として、3次元目にこの値を割り振る設定をしている(この軸はFnMODEがQFになる)。割り振る値は、VDLISTで指定したテキストファイルを用いる。
このVDLISTは、Variable delay listであり待ち時間(delay)を割り振るためのファイルである。今まで当施設で用いてきたR2-dispersion法におけるVDLISTでは、CPMGブロックにおいて、180˚パルスが一定間隔の中に何回繰り返すかを示す周波数について書いていた。ただ、これはパルス照射を指定していることになり、delay=パルスを照射しない待ち時間であるという定義に抵触するものと思われる。
おそらくであるが、この抵触するという問題を解決するために、CPMGブロックをRF_fieldの変数として代入するようパルスプログラムが書き換えが行われた(pp/trrexetf3gpsi3dを参考とした)。書き換えられたパルスプログラムは、これまたおそらくな話で申し訳ないが、TopSpin 4.0以降には標準で実装されている。さらに、TopSpin 4.1からはRF_fieldの変数として指定されていないパルスプログラムはエラー扱いとして、実行できなくなった(このエラーが出たために、小話を描く羽目になった)。
また、これらのこととの関連性は定かではないが、RF_field変数指定の入ったパルスプログラムは、当施設の環境ではそのシークエンスを表示させることができない。
リモートNMR測定講習会 後記
1st draft 2021.3.18
last update 2021.7.20
 2021年3月15、16日に「蛋白研セミナー・TIAかけはし共催 基礎から学ぶ最新NMR解析法、リモート測定」が開催され、運営サイドの助っ人として参加させていただいた。聴講者を含め関係各位の皆様に対し、この場にて深く御礼申し上げる。
2021年3月15、16日に「蛋白研セミナー・TIAかけはし共催 基礎から学ぶ最新NMR解析法、リモート測定」が開催され、運営サイドの助っ人として参加させていただいた。聴講者を含め関係各位の皆様に対し、この場にて深く御礼申し上げる。
筆者はこのリモート講習会で、「共用NMR拠点の紹介」「リモート測定」のそれぞれの一部について担当させていただいた。「共用NMR拠点の紹介」で使用したスライドは、ここのWebページを切りはりしただけのものである。「リモート測定」に関しても同じくこのWebページの「テキスト」に掲載していることをベースに対応した。
講習会では、migiSJならびにhidariのBruker AVANCE NEO 800 MHz NMRを使用した。TopSpinは4.1.1を使用した。講習会の一部で本施設でのみ使用可能なコマンド等を使用した。それらについて補足解説する。
logbookコマンド
装置のBSMS関連の状況を吐き出すAUプログラムである。TopSpin 3系とTopSpin 4系ではBSMSをコントロールするコマンドに若干の変更があったため、両者では違うプログラムを使用している。装置維持管理のために、ローカル利用者全員に対しては、測定開始時のfield値、lock関連パラメータ類、使用フォルダ等は使用ログとしてノートに記載していただいている。リモート測定においては、このプログラムによりテキストファイルとして保存していただくことになる。
nhsqcやhmqcコマンド
パルスプログラムを含む測定パラメータについて質問形式で選択することができるPythonスクリプトである。基本的には、ZGPR等での校正済みの測定条件を、new -> use current parameterにより引き継いだ新しいexpnoの上で使用する。これらのコマンドでは、それぞれのサンプルに適したp1値やo1値などを引き継ぎ、rparの対象となるパルスパラメータをボタン選択により選択させ、引き継いだパラメータについてgetprosol 1H p1値 p1dB値 の要領で更新を行う。原作者は他にあり、筆者はこれを改変して運用しているにすぎない。
これらパルスプログラムが選択されるPythonスクリプトは、TopSpin 3系、4系において大きな差異なく使用が可能であるが、TopSpin 2以前である場合には変更すべき点が多く流用は難しいかもしれない。これらは参考資料とし自力で改変するのが良いだろう。
iconnmr環境設定
SampleJETでの自動連続測定を行う際には、iconnmrによる測定制御が必要である。これによりUV分光計感覚でのHSQC測定が可能だ。ただもちろん、タンパク質測定に特化したパラメータ設定ファイルがデフォルトで用意されているわけではないため、自前でそのファイルを用意しておく必要がある。
wparにてリモート測定専用のパラメータファイル(zgpr_remote、nhsqc_remote、hmqc_remote)をそれぞれ作成する。pulsecalをiconnmrが自動実行するAUプログラム(AUNM)に追記した(pulsecal_zg)。シム調整はedlockで専用のロック溶媒ファイル(H2O+D2O_remote、D2O_remote)を作成しておき、シム調整パラメータ類をここで制御しておくと良いだろう。筆者はrshにて筆者の標準サンプルでのシムファイル読み込み、topshim fineだけを行うように設定した。
シム調整、さいごの一押しの話
1st draft 2021.2.21
last update 2021.3.3
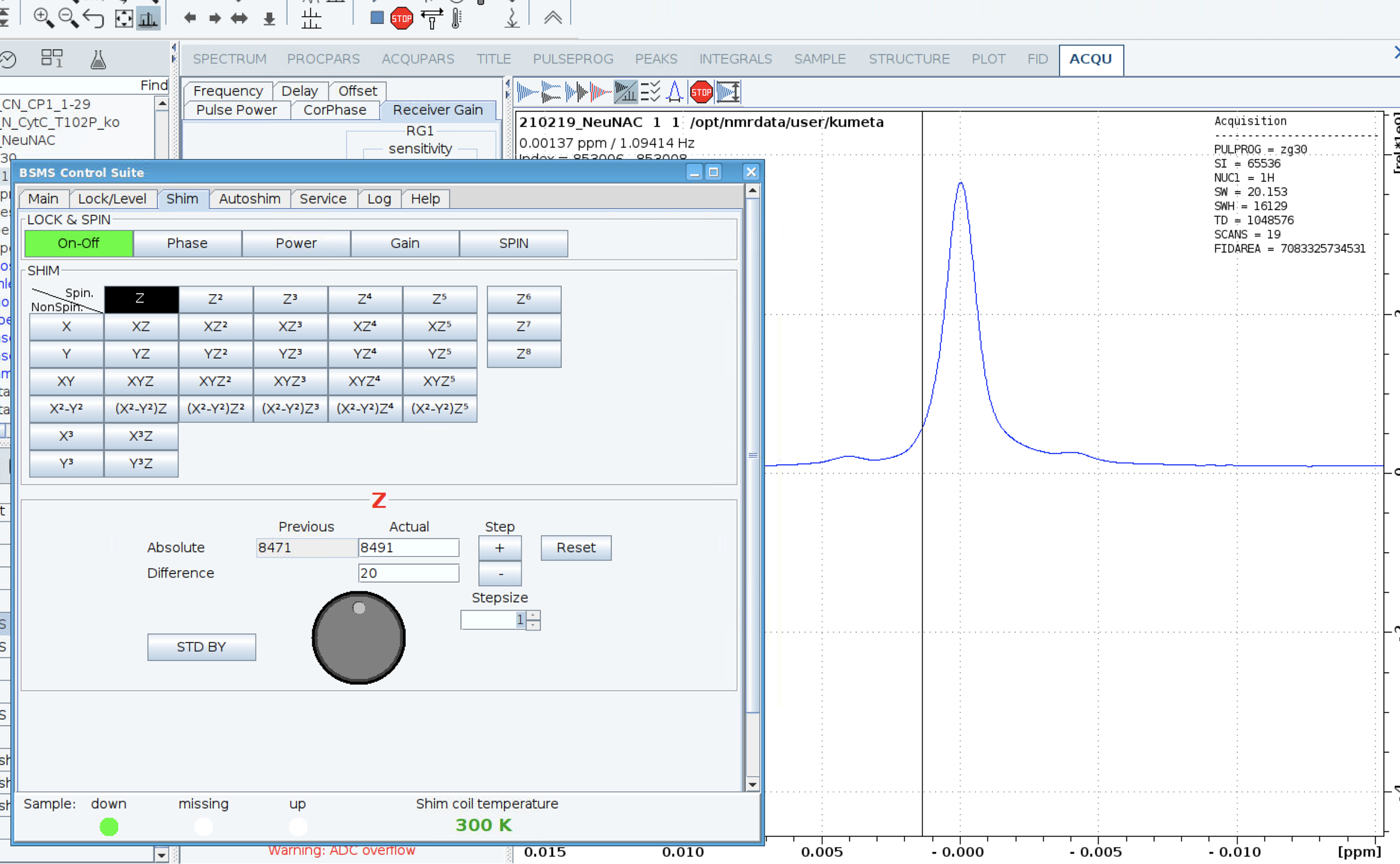 topshimによる自動シム調整は、Brukerの装置を使用している方にはお馴染みの操作であろうと思う。古くからのgradient mapを使った調整、MRIに使われる様な3Dイメージからの調整、shaped pulseを用いての効率化、パラメータ入力による制御の簡素化、最近であればiteration機能実装による最適値探索などのさまざまな利点がある一方、自動調整後のシム状態が測定者にとって必ずしも十分なものではないこともありえる。この欠点は、溶液タンパク質のシグナル観測ではほぼ無視できるレベルだが、低分子化合物での測定やメタボロミクス解析などにおいてはシビアな問題になりえる。その場合、最終的な手動調整が必要になる。
topshimによる自動シム調整は、Brukerの装置を使用している方にはお馴染みの操作であろうと思う。古くからのgradient mapを使った調整、MRIに使われる様な3Dイメージからの調整、shaped pulseを用いての効率化、パラメータ入力による制御の簡素化、最近であればiteration機能実装による最適値探索などのさまざまな利点がある一方、自動調整後のシム状態が測定者にとって必ずしも十分なものではないこともありえる。この欠点は、溶液タンパク質のシグナル観測ではほぼ無視できるレベルだが、低分子化合物での測定やメタボロミクス解析などにおいてはシビアな問題になりえる。その場合、最終的な手動調整が必要になる。
この欠点の特にひどいところだと思うが、プロトン信号線形が良くなる方向へのシム調整がロックレベルの高さと連動していない。これはロックレベルを見ながらのシム調整ができないことを意味する。gsモードによるスペクトルを見ながらの調整が必要になる。TSPやDSSなど標準物質のサテライト信号が観測されるまでの調整が必要なこともあるだろう。topshimによる自動調整後、gsモードでスペクトルを表示させ0 ppm付近を拡大する。線形を確認しながらBSMS controlによりシム調整をする。
topshimによる自動調整後の手動調整では、当施設にあるBruker装置全般にzの調整だけでシム状態が向上した。migiSJはzに+10、hidariは+20といった具合に、その調整値も一定であった。そこでBrukerに依頼し、AUプログラム(addshim)を作成いただいた。これによりmigSJとhidariはコマンドaddshim z 10の要領での調整が可能になった。ただし、前述のようにロックレベルが下がる欠点があるため、Autoshim onは使えない。
さらに、topspin 4.1.1からこれを加味したtopshim parameterが追加された。tcorr=10でzのシム値に10が追加できるようになった。(記入例:topshim fine rga shigemi tcorr=10)。しかしAutoshim onが使えないことに変わりはない。
利用開放トラブル事例
1st draft 2021.1.28
last update 2021.1.31
 当施設ではNMR装置の利用開放を行なっている。利用者の皆様には装置の使用上の注意点について、各種お手製マニュアル(テキスト参照)や初回講習等で対応しているが、少なからずトラブルは発生する。それらについて体験談や解決方法提示として列挙しておく。
当施設ではNMR装置の利用開放を行なっている。利用者の皆様には装置の使用上の注意点について、各種お手製マニュアル(テキスト参照)や初回講習等で対応しているが、少なからずトラブルは発生する。それらについて体験談や解決方法提示として列挙しておく。
異物挿入関連
過去にサンプルゲージを挿入、サンプル管+ホルダーの追加挿入、サンプル管なしのホルダー挿入があった。これらはリフトエアーを強くすることで取り出せることがある。リフトエアーを強くしても取り出せない場合には、トリモチを作って取り出す。NMR装置の近くには液体ヘリウムの液量測定のために気柱振動を測定するためのとても長い器具が常備されている。これの先端部分に布テープを粘着部分が外側になるように巻きつけ、トリモチを作成する。これを装置上部より差し込み、間違った状態で装置内に入ってしまった異物を取り出す。これでも取れない場合や内部でサンプル管が割れてしまった場合などはプローブやアッパーバレルの取り外し、もしかすると内部清掃もありえる。
リサイクルサンプル管
サンプル管は安いもので1本100円程度から、高ければ1万円ほどのものもある。サンプル管を洗浄して再利用することもあるだろう。洗浄後のサンプル管を乾燥させるために加熱乾燥機を使用することがある。このとき、ビーカーの縁などに立てかけて乾燥させるとサンプル管は曲がるおそれがある(サンプル管の種類にもよるが目安として60˚C以上から曲がる)。曲がったサンプル管を使うと、ホルダーにさせなくなったりプローブにまでサンプルが届かない、最悪の場合サンプル管が装置内部で割れるなどの障害がありえる。サンプル管の曲がり具合は平坦な机上で転がす、またはゲージに刺した状態でクルクル回すとわかる。加熱乾燥機を使用する場合には、広げたアルミホイルの上など平坦な環境で乾燥させる。
また、サンプル管洗浄の際にサンプル検出部位に細かな傷がついた場合、シム調整に影響がでる。使用する重溶媒のみをいれたシム調整のテストをしておくことが良いだろう。筆者はシゲミ社の水溶液用対称形ミクロサンプルチューブ、通称shigemi管をよく使う。これをリサイクルしたときには洗浄終了後に70 %重水+DSS(使い回し)によるシムテストを行なっている。
15Nラベル体でがんばる話
1st draft 2021.1.28
last update 2021.6.27
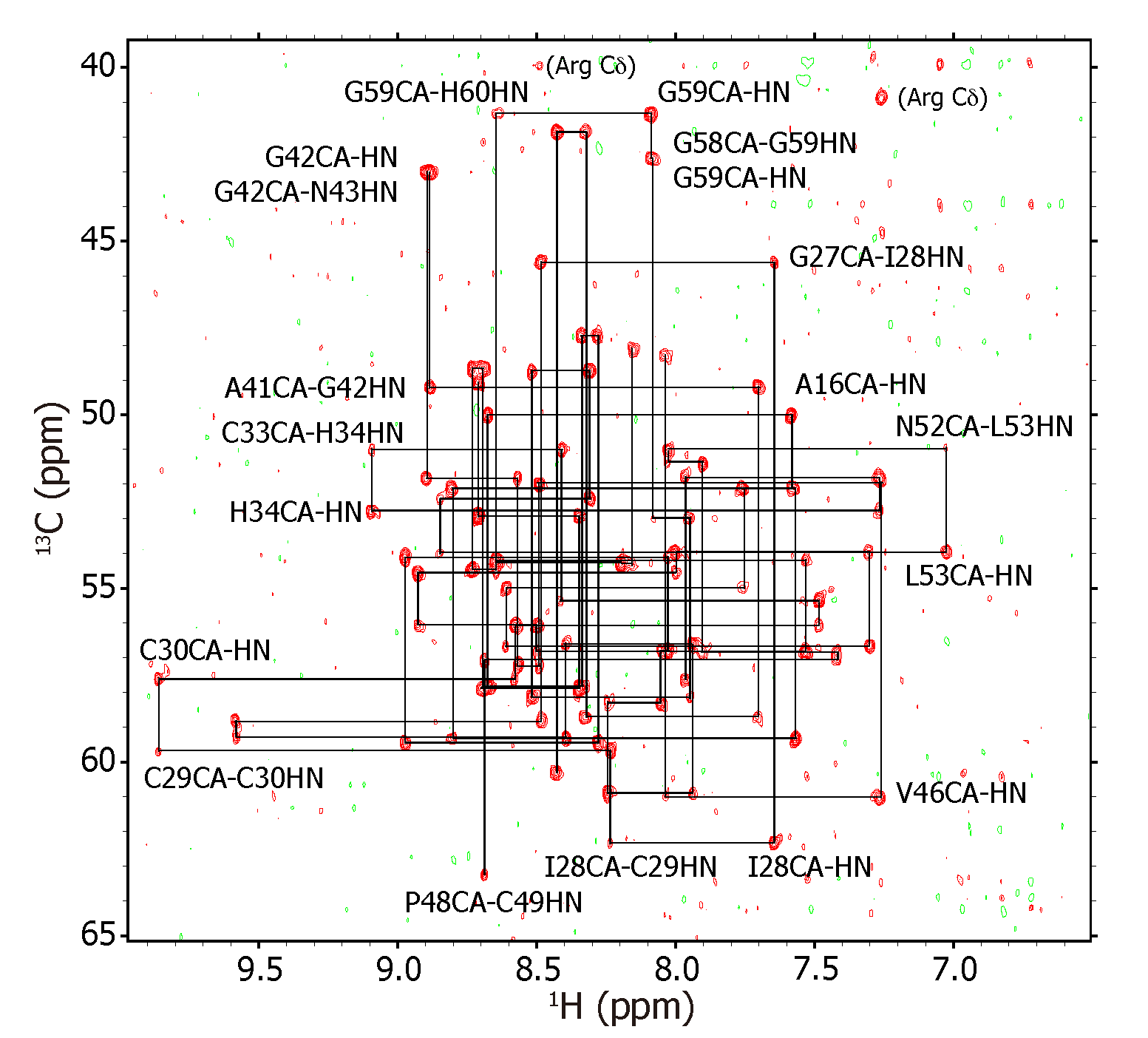 溶液タンパク質NMRによる測定と解析を行う際に、13C/15Nラベル体作成は多くのNMR研究室にとって一般的に行われている。しかし13Cラベル化試薬は一般的に高価であり、潤沢な研究費をもたない研究室や普段から溶液タンパク質NMRを手掛けていない研究室(含 NMRを測定してみたいサンプルをかかえている研究室)にとっては未だ高い壁として存在している。一方で、15Nラベル体であれば比較的安価に調整できるようになってきている(数千円くらいからのオーダー)。13C/15Nラベル体作成に比べ、大腸菌を用いた場合には1/5〜1/10程度、メタノール酵母を用いた場合には1/20くらいの予算でサンプル調整が可能である(筆者イメージ比、参考文献なし)。ただ、15Nラベル体だけでの主鎖帰属や構造解析用測定といえば、古くは15N-TOCSY、15N-NOESYのみであった(人によってはHNHAも使うらしいが)。これらは得られる信号情報が解析初心者にとって容易ではなく、難易度が高い。
溶液タンパク質NMRによる測定と解析を行う際に、13C/15Nラベル体作成は多くのNMR研究室にとって一般的に行われている。しかし13Cラベル化試薬は一般的に高価であり、潤沢な研究費をもたない研究室や普段から溶液タンパク質NMRを手掛けていない研究室(含 NMRを測定してみたいサンプルをかかえている研究室)にとっては未だ高い壁として存在している。一方で、15Nラベル体であれば比較的安価に調整できるようになってきている(数千円くらいからのオーダー)。13C/15Nラベル体作成に比べ、大腸菌を用いた場合には1/5〜1/10程度、メタノール酵母を用いた場合には1/20くらいの予算でサンプル調整が可能である(筆者イメージ比、参考文献なし)。ただ、15Nラベル体だけでの主鎖帰属や構造解析用測定といえば、古くは15N-TOCSY、15N-NOESYのみであった(人によってはHNHAも使うらしいが)。これらは得られる信号情報が解析初心者にとって容易ではなく、難易度が高い。
昨今の感度が向上された装置環境があれば、天然存在比(1%)の13C核を利用した主鎖帰属測定が可能である。13C-13Cのカップリングを利用している測定方法は使用できないため、HNCAやHNCOのみを用いることになるが、これらと15N-TOCSY、15N-NOESYとを併用することで解析の難易度は格段に下がる。主鎖帰属を一度でもやったことがある人にとっては周知であるが、HNCAで観測されるCAの信号はHNと同じ残基内にあれば強信号、一つ前の残基であれば弱信号として観測できる。HNCOはBMRBよりNMRデータが既存の近縁タンパク質の情報との比較において活用する。
積算回数をかせぐために、3次元展開をしないことも一つの手段である。HNCAであれば15N軸を展開せずHNとCAの2次元で測定と解析をする。3次元展開しないことでシグナルの分離能が悪いと考えるかもしれない。しかし、直接観測軸のプロトン分解能は他の軸に比べて格段に高く、また、少しの測定温度変化によってHNの化学シフト値は移動してくれるので、ここはあまり問題にならない。また、通常の3次元測定では128回積算くらいが上限だが、2048回や4096回といった積算が現実的に可能である。さらにはGFTやAPSY(もしくはProjection Reconstruction)を活用すればNの情報が反映されたCAの情報も取得できるため、1H-15N HSQC上で15N軸に沿って並んでいる信号の分離も可能だろう。筆者は15N-NOESYを使うが。
この3次元展開をしない手法は、濃度が低いなどにより充分な感度が得られそうにない13C/15Nや2D/13C/15Nラベル体でも使えるし、使った(PubMedリンク)。
15Nラベル体サンプルの側鎖帰属にHCCH-TOCSYや13C-NOESYは利用できない。15N-decoupled 2D-TOCSYと1H-13C HSQC(天然存在比13C)を用いた。また構造解析を目的としたときに15N-NOESYだけでは情報が限定的となってしまい、得られる立体構造は精度にかける。ここには15N-decoupled 2D-NOESYも併用した(この構造情報については、in preparationのはず)。手元にノンラベル体があるのであれば、15N-decoupleパルスシークエンスを用いずにデータ取得しても構わないのだが、実際のところ、筆者のところに送られてくるこの手のサンプルには、ノンラベル体タンパク質が含まれることがないためこの手法を用いている。
Cryogenic Probeとサンプル温度の話
1st draft 2021.1.26
last update 2021.1.26
 Cryogenic Probeは検出コイルを極低温環境(およそ25ケルビン)にすることでデジタルノイズを減らしNMRの感度を向上させている。Cryogenic Probeにおける感度向上効果が、サンプルの塩濃度(主に電気伝導度)による影響をうける話は、他者の記事で散々言われていることなので、ここでは割愛する(5 mm NMR tubeのとき400 mM NaClぐらいでCryogenicであるメリットは消える、もしかすると他の小話として書くかも)。NMRサンプルと検出コイルと、それぞれの環境温度には大きな差があるため、両者の間には真空断熱層がある。しかし完全に断熱できているわけではなく、両環境間での温度交換はわずかながらに生じている。
Cryogenic Probeは検出コイルを極低温環境(およそ25ケルビン)にすることでデジタルノイズを減らしNMRの感度を向上させている。Cryogenic Probeにおける感度向上効果が、サンプルの塩濃度(主に電気伝導度)による影響をうける話は、他者の記事で散々言われていることなので、ここでは割愛する(5 mm NMR tubeのとき400 mM NaClぐらいでCryogenicであるメリットは消える、もしかすると他の小話として書くかも)。NMRサンプルと検出コイルと、それぞれの環境温度には大きな差があるため、両者の間には真空断熱層がある。しかし完全に断熱できているわけではなく、両環境間での温度交換はわずかながらに生じている。
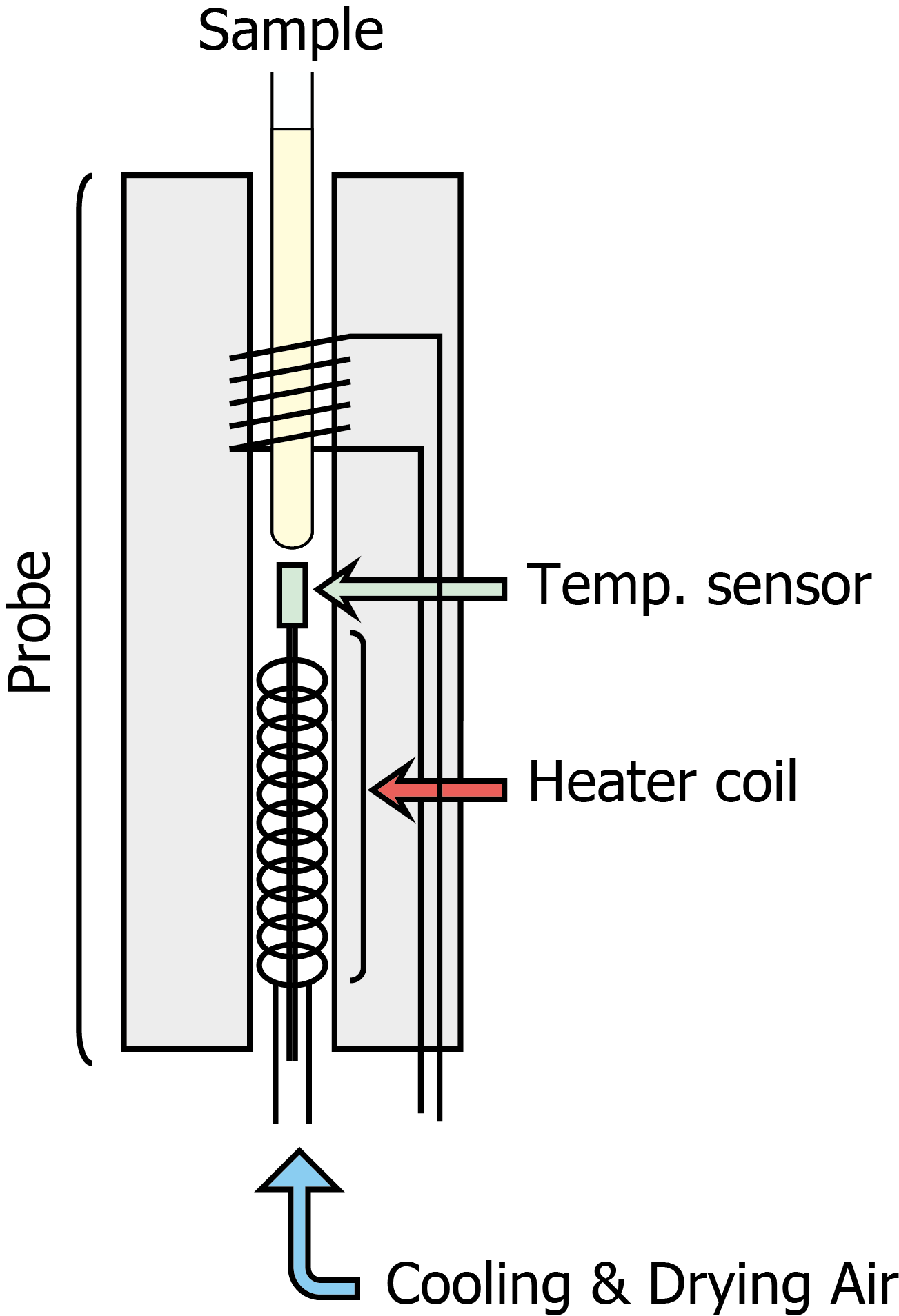
サンプル空間における急激な温度変化は、検出コイル空間の極低温にとって好ましくない。実際に温度調節するときには、現在の温度から目的温度に向けて、5˚Cくらいの幅で設定値を変え、温度が安定してから5分ほどそのままにして(できればコイル温度をモニターしておき、それが安定するのをまってから)、次の設定値にすすむことが望ましい。Brukerの装置、TopSpin 3以降であればedte(Temperature Control Suite)上で、この設定が可能になっている(Configuration タブから、Regulation modeをSlope limitedにする)。
プローブ内部のサンプルが入る部分には、設定温度よりもやや低温のガスが下方より送りこまれている。このガスはヒーターにより加熱調整されてから、サンプル周囲に行き届く。ヒーターとサンプル周囲部分の間に温度センサーがあり、ヒーター加熱量を調整することで温度制御している。Cryogenic Probeの場合には、センサーがモニターしている温度とサンプル環境温度には若干の差が生じている(Cryogenic Probeでなくとも、室温と設定温度に大きな差があれば影響はある)。実際には3˚C程度の差が生じていることもある。これは装置間での化学シフト値が異なる原因にもなるし、温度の項目が計算式にはいる緩和分散法において、わりとシビアな問題である。これらを解消するためには、それぞれの装置環境ごとに温度補正が必要である。実際の温度補正の方法は、テキストにおいて解説するとして、ここでは概要だけにとどめる。メタノールのCH3とOHの信号のように、化学シフト値の温度感受性が高いサンプルを用いて補正する。2点以上の設定温度(たとえば5と35˚C)でそれぞれ1次元を測定する。それぞれの設定温度におけるシグナルの分離幅からサンプルの実温度を計算する。筆者は実温度の計算には、ここのサイトを使用している。
http://chem.ch.huji.ac.il/nmr/software/thermometer.html
実測値と設定値のズレから補正値および補正係数をもとめる。
ヒーターはサンプル下方にあり、Cyrogenic Probeでは横方向から冷やされていくため、サンプルの縦軸方向に温度勾配が発生しうる。この温度勾配が発生しないように、温度調整のためのフローレートを調整しておくと良いだろう。筆者はBruker装置での目安として、標準のCDCl3溶媒サンプルを用いてtopshim 1Dがfailにならないくらいの風量としている(温度勾配があるとサンプル内部で対流が発生し、profile mapが取れなくなってfailになることを利用している)。実際には 600 lph程度のTarget gas flowにしている。Target gas flowを変更した場合には上記の温度補正値、補正係数が変わるので再度の補正が必要になることにも留意する。
準備中
高速測定技術の話
外部ロックの話
J分解測定とカップリングなしの1Dスペクトルの話
| 
 shigemi社製の対称型微量サンプルチューブ(通称、shigemi管)は、普段から溶液タンパク質NMRを測定する上で非常にお世話になっている。NMR測定に使用するサンプル液量を、通常600 uL程度が必要なところ、250 uLでの測定が可能であり、これは高濃度のサンプルを用意するうえで非常に重要である。
shigemi社製の対称型微量サンプルチューブ(通称、shigemi管)は、普段から溶液タンパク質NMRを測定する上で非常にお世話になっている。NMR測定に使用するサンプル液量を、通常600 uL程度が必要なところ、250 uLでの測定が可能であり、これは高濃度のサンプルを用意するうえで非常に重要である。 周波数ロックを行うときには、lockコマンドによりロックに使用する溶媒を選択する。新しい溶媒系(90% H2O+10% d6-DMSOなど)を用いたいときや、iconNMRにおける自動測定のときにシム上げ方法を条件分けしたいときなど、それをあらかじめロック溶媒リストに追加しておく必要がある。ロック溶媒リストの編集は、edlock(呼び出しコマンドもedlock、要管理者パスワード)によって行う。ロック溶媒情報の編集、たとえば2種類の重水素信号が含まれている場合に、両者の化学シフト値の設定ならびに、どちらをロック信号とするかなどの設定が可能である。
周波数ロックを行うときには、lockコマンドによりロックに使用する溶媒を選択する。新しい溶媒系(90% H2O+10% d6-DMSOなど)を用いたいときや、iconNMRにおける自動測定のときにシム上げ方法を条件分けしたいときなど、それをあらかじめロック溶媒リストに追加しておく必要がある。ロック溶媒リストの編集は、edlock(呼び出しコマンドもedlock、要管理者パスワード)によって行う。ロック溶媒情報の編集、たとえば2種類の重水素信号が含まれている場合に、両者の化学シフト値の設定ならびに、どちらをロック信号とするかなどの設定が可能である。 依頼測定において預かったサンプルのなかに、水とそれ以外の溶媒由来信号が含まれてる場合がある。
例えば、水とヘリックス誘導剤であるTFEの混合溶媒などである。
D化TFEを使用すればもちろん観測できなくなるが、D化溶媒が売っていない、売っていてもとても高額など、これらは実験をすすめる上で障壁になりうる。
また、共同研究先に高額なD溶媒をポーンと買ってもらうことにも、気が引けることがたまーにある。
(自前で買うことは考えられないし考えない)。
依頼測定において預かったサンプルのなかに、水とそれ以外の溶媒由来信号が含まれてる場合がある。
例えば、水とヘリックス誘導剤であるTFEの混合溶媒などである。
D化TFEを使用すればもちろん観測できなくなるが、D化溶媒が売っていない、売っていてもとても高額など、これらは実験をすすめる上で障壁になりうる。
また、共同研究先に高額なD溶媒をポーンと買ってもらうことにも、気が引けることがたまーにある。
(自前で買うことは考えられないし考えない)。 当施設では複数のNMR装置について維持管理している。長年の維持管理においてハードウェアトラブルは、よく体験する。それらのトラブルの症状と解決方法のなかで、のちのち参考となりそうなものを抜粋して備忘録として記載する。
当施設では複数のNMR装置について維持管理している。長年の維持管理においてハードウェアトラブルは、よく体験する。それらのトラブルの症状と解決方法のなかで、のちのち参考となりそうなものを抜粋して備忘録として記載する。 ハードパルスを必要としない場合や出力の強いパルスを照射したくないときなどに使用するshaped pulseは、昨今のパルスシークエンスにはほぼ必ずと言っていいほど登場する。化学シフト値特異的なパルス、いわゆる選択的パルスはselective実験やSTD実験で使用されているし、Adiabatic pulseは低分子HSQCでの解析を助けてくれる。タンパク質NMRにおいても、watergate実験における水消しに始まり、広い観測幅をもつAliphatic Carbonのデカップルパルス、HCNの三次元測定の13Cパルス、CS/TCSのための飽和パルス測定、sofast測定やselective HMQC-NOESY-HMQC測定など、ありとあらゆる場面で登場してくる。
ハードパルスを必要としない場合や出力の強いパルスを照射したくないときなどに使用するshaped pulseは、昨今のパルスシークエンスにはほぼ必ずと言っていいほど登場する。化学シフト値特異的なパルス、いわゆる選択的パルスはselective実験やSTD実験で使用されているし、Adiabatic pulseは低分子HSQCでの解析を助けてくれる。タンパク質NMRにおいても、watergate実験における水消しに始まり、広い観測幅をもつAliphatic Carbonのデカップルパルス、HCNの三次元測定の13Cパルス、CS/TCSのための飽和パルス測定、sofast測定やselective HMQC-NOESY-HMQC測定など、ありとあらゆる場面で登場してくる。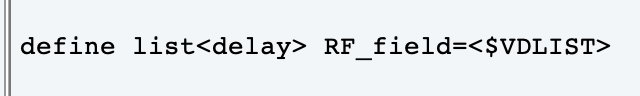 15N標識を用いた溶液タンパク質NMR測定におけるT1/T2およびNOE測定、R2-dispersion法などにおいて、本来、複数枚の2次元測定が必要になるところを擬似的に3次元測定とする測定方法は、わりと一般的に用いられている。Pseudo 3D法とも呼ばれる、この測定方法は任意に変更させたいパラメータについて3次元目としている。例えば、T1やT2であればパルスの待ち時間であるdelayをユーザー任意(variable)な値として、3次元目にこの値を割り振る設定をしている(この軸はFnMODEがQFになる)。割り振る値は、VDLISTで指定したテキストファイルを用いる。
15N標識を用いた溶液タンパク質NMR測定におけるT1/T2およびNOE測定、R2-dispersion法などにおいて、本来、複数枚の2次元測定が必要になるところを擬似的に3次元測定とする測定方法は、わりと一般的に用いられている。Pseudo 3D法とも呼ばれる、この測定方法は任意に変更させたいパラメータについて3次元目としている。例えば、T1やT2であればパルスの待ち時間であるdelayをユーザー任意(variable)な値として、3次元目にこの値を割り振る設定をしている(この軸はFnMODEがQFになる)。割り振る値は、VDLISTで指定したテキストファイルを用いる。 2021年3月15、16日に「蛋白研セミナー・TIAかけはし共催 基礎から学ぶ最新NMR解析法、リモート測定」が開催され、運営サイドの助っ人として参加させていただいた。聴講者を含め関係各位の皆様に対し、この場にて深く御礼申し上げる。
2021年3月15、16日に「蛋白研セミナー・TIAかけはし共催 基礎から学ぶ最新NMR解析法、リモート測定」が開催され、運営サイドの助っ人として参加させていただいた。聴講者を含め関係各位の皆様に対し、この場にて深く御礼申し上げる。 topshimによる自動シム調整は、Brukerの装置を使用している方にはお馴染みの操作であろうと思う。古くからのgradient mapを使った調整、MRIに使われる様な3Dイメージからの調整、shaped pulseを用いての効率化、パラメータ入力による制御の簡素化、最近であればiteration機能実装による最適値探索などのさまざまな利点がある一方、自動調整後のシム状態が測定者にとって必ずしも十分なものではないこともありえる。この欠点は、溶液タンパク質のシグナル観測ではほぼ無視できるレベルだが、低分子化合物での測定やメタボロミクス解析などにおいてはシビアな問題になりえる。その場合、最終的な手動調整が必要になる。
topshimによる自動シム調整は、Brukerの装置を使用している方にはお馴染みの操作であろうと思う。古くからのgradient mapを使った調整、MRIに使われる様な3Dイメージからの調整、shaped pulseを用いての効率化、パラメータ入力による制御の簡素化、最近であればiteration機能実装による最適値探索などのさまざまな利点がある一方、自動調整後のシム状態が測定者にとって必ずしも十分なものではないこともありえる。この欠点は、溶液タンパク質のシグナル観測ではほぼ無視できるレベルだが、低分子化合物での測定やメタボロミクス解析などにおいてはシビアな問題になりえる。その場合、最終的な手動調整が必要になる。 当施設ではNMR装置の利用開放を行なっている。利用者の皆様には装置の使用上の注意点について、各種お手製マニュアル(テキスト参照)や初回講習等で対応しているが、少なからずトラブルは発生する。それらについて体験談や解決方法提示として列挙しておく。
当施設ではNMR装置の利用開放を行なっている。利用者の皆様には装置の使用上の注意点について、各種お手製マニュアル(テキスト参照)や初回講習等で対応しているが、少なからずトラブルは発生する。それらについて体験談や解決方法提示として列挙しておく。 溶液タンパク質NMRによる測定と解析を行う際に、13C/15Nラベル体作成は多くのNMR研究室にとって一般的に行われている。しかし13Cラベル化試薬は一般的に高価であり、潤沢な研究費をもたない研究室や普段から溶液タンパク質NMRを手掛けていない研究室(含 NMRを測定してみたいサンプルをかかえている研究室)にとっては未だ高い壁として存在している。一方で、15Nラベル体であれば比較的安価に調整できるようになってきている(数千円くらいからのオーダー)。13C/15Nラベル体作成に比べ、大腸菌を用いた場合には1/5〜1/10程度、メタノール酵母を用いた場合には1/20くらいの予算でサンプル調整が可能である(筆者イメージ比、参考文献なし)。ただ、15Nラベル体だけでの主鎖帰属や構造解析用測定といえば、古くは15N-TOCSY、15N-NOESYのみであった(人によってはHNHAも使うらしいが)。これらは得られる信号情報が解析初心者にとって容易ではなく、難易度が高い。
溶液タンパク質NMRによる測定と解析を行う際に、13C/15Nラベル体作成は多くのNMR研究室にとって一般的に行われている。しかし13Cラベル化試薬は一般的に高価であり、潤沢な研究費をもたない研究室や普段から溶液タンパク質NMRを手掛けていない研究室(含 NMRを測定してみたいサンプルをかかえている研究室)にとっては未だ高い壁として存在している。一方で、15Nラベル体であれば比較的安価に調整できるようになってきている(数千円くらいからのオーダー)。13C/15Nラベル体作成に比べ、大腸菌を用いた場合には1/5〜1/10程度、メタノール酵母を用いた場合には1/20くらいの予算でサンプル調整が可能である(筆者イメージ比、参考文献なし)。ただ、15Nラベル体だけでの主鎖帰属や構造解析用測定といえば、古くは15N-TOCSY、15N-NOESYのみであった(人によってはHNHAも使うらしいが)。これらは得られる信号情報が解析初心者にとって容易ではなく、難易度が高い。 Cryogenic Probeは検出コイルを極低温環境(およそ25ケルビン)にすることでデジタルノイズを減らしNMRの感度を向上させている。Cryogenic Probeにおける感度向上効果が、サンプルの塩濃度(主に電気伝導度)による影響をうける話は、他者の記事で散々言われていることなので、ここでは割愛する(5 mm NMR tubeのとき400 mM NaClぐらいでCryogenicであるメリットは消える、もしかすると他の小話として書くかも)。NMRサンプルと検出コイルと、それぞれの環境温度には大きな差があるため、両者の間には真空断熱層がある。しかし完全に断熱できているわけではなく、両環境間での温度交換はわずかながらに生じている。
Cryogenic Probeは検出コイルを極低温環境(およそ25ケルビン)にすることでデジタルノイズを減らしNMRの感度を向上させている。Cryogenic Probeにおける感度向上効果が、サンプルの塩濃度(主に電気伝導度)による影響をうける話は、他者の記事で散々言われていることなので、ここでは割愛する(5 mm NMR tubeのとき400 mM NaClぐらいでCryogenicであるメリットは消える、もしかすると他の小話として書くかも)。NMRサンプルと検出コイルと、それぞれの環境温度には大きな差があるため、両者の間には真空断熱層がある。しかし完全に断熱できているわけではなく、両環境間での温度交換はわずかながらに生じている。